火焰原子吸收光谱法测食品中钙时,磷的干扰较大,国标法确定用什么抑制磷的干扰( )。
A、10%氧化铜
B、10%氧化镁
C、20g/L氧化镧
D、20g/L氧化镁
E、10g/L氧化铜
下列说法正确的是()
A.氢氧化钠露置在空气中不易变质
B.在高温下,木炭能与氧化铜发生反应,说明氧化铜具有还原性
C.铁桶不能用于盛装波尔多液
D.向稀盐酸中加入水稀释,盐酸溶液浓度降低,pH逐渐减小
用火焰原子吸收光谱法测食品含钙量,受磷的干扰较大,国标法确定的用于抑制磷干扰的物质是()
A、10%氧化铜
B、20g/L氧化镧
C、10g/L氧化铜
D、10%氧化镁
E、20g/L氧化镁
氢气还原氧化铜的实验过程中,包含四步操作:①加热盛有氧化铜的试管;②通入氢气;③撤去酒精灯;④继续通入氢气直至冷却,正确的操作顺序是().
A.①②⑧④
B.②①③④
C.②①④③
D.①②④③
在实验室中用锌、氧化铜、稀硫酸做原料制取铜,有下列两种途径:若用这两种方法制得铜的质量相等,下列叙述符合实验结果的是()
A消耗相同质量的氧化铜
B消耗相同质量的锌
C消耗相同质量的稀硫酸
D生成硫酸锌的质量相同
下列叙述中正确的是( ).
A、在氢气跟氧化铜的反应中,氢气是得氧的物质,所以氢气是氧化剂
B、氢气具有还原性,所以氢气跟氧化铜的反应是一个还原反应
C、电解水产生H2和O2,所以水是由H2和O2组成的
D、在点燃氢气之前,必须验纯
某活动小组用废铜制取硫酸铜溶液,实验过程为:
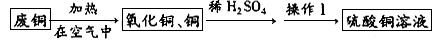
⑴废铜在空气中加热后得到的氧化铜中含有少量铜,原因是_____(填字母序号)。a.加热时氧化铜易分解生成铜b.铜与氧气没有完全反应c.加热时铜不能与氧气反应⑵氧化铜与稀硫酸反应的化学方程式为__________。⑶操作Ⅰ的名称是___\_,该操作用到的玻璃仪器有:玻璃棒、烧杯、______。⑷盛放硫酸铜溶液不宜用铁制容器的原因是(用化学方程式解释)____________。
将N2、CO、H2、CO2四种气体的混合气体:
(1)依次通过灼热的氧化铜、石灰水、浓H2SO4,最后得到的气体是________。
(2)依次通过石灰水,灼热的氧化铜,浓H2SO4,最后得到的气体是________。
某有机物0.1摩和标准状况下的氧气5.6升恰好反应完全,所得产物为CO2、CO、H2O(气),产物通过盛浓硫酸的洗气瓶,洗气瓶的质量增加了5.4克,再通过灼热的氧化铜,氧化铜的质量减轻了1.6克,再通过装有碱石灰的干燥管,干燥管增加了8.8克.求有机物的分子式.
现有0.2mol有机物于0.5mol氧气在一密闭容器中燃烧,得产物为CO2、CO、H2O.产物通过浓硫酸时,浓硫酸的质量增加10.8g;通过灼热氧化铜时,氧化铜的质量减轻了3.2g;又通过碱石灰时,碱石灰的质量增加了17.6g.试求:
(1)有机物的分子式(写出计算过程)
(2)写出该有机物可能的结构简式.
有一包黑色粉末,可能是铁粉、木炭粉、氧化铜中的一种或几种,为了证明它的组成,进行如下探究实验
(1)验证并分离铁粉的最简单的物理方法是______.
(2)通过实验已证明该包黑色粉末没有铁粉,再取黑色粉末少许于试管中,加入足量的稀硫酸微热,现象______,结论是黑色粉末只含有氧化铜.
写出上述反应中的化学方程式:______.
某有机物9.2g和0.3mol氧气在密闭容器中燃烧后,产物为CO2、CO和H2O,产物经过浓硫酸后,浓硫酸质量增加7.2g,再通过灼热的氧化铜,充分反应后,氧化铜质量减轻1.6g,最后气体再通过碱石灰,碱石灰质量增加13.2g。若同量该有机物与6.9g钠恰好反应。计算并回答有机物的分子式及结构简式。
为了除去物质中的杂质(括号内物质为杂质),所选用试剂和操作方法都正确的是()
物 质
选用试剂(过量)
操作方法
A
O2(N2)
铜网
加热
B
Cu(Fe)
稀盐酸
加入稀盐酸充分反应后过滤、洗涤
C
CuSO4溶液(H2SO4)
氧化铜
加入氧化铜粉末充分反应后过滤
D
盐酸(H2SO4)
硝酸钡溶液
加入硝酸钡溶液充分反应后过滤
A.A
B.B
C.C
D.D
某液态有机物0.1mol与0.3mol氧气混合,于密闭容器中用电火花点火,燃烧完毕,将燃烧产物通入过量澄清石灰水中,可生成白色沉淀20.0g,溶液质量减少5.8g,剩余气体继续通过灼热的氧化铜,可使氧化铜质量减少1.6g.又知该有机物能跟金属钠发生置换反应,还能发生银镜反应.通过计算写出该有机物的化学式,判断该有机物的结构简式.
普通玻璃瓶常有绿色是因为含有()
A.氧化铜
B.FeSO4
C.KCl
D.氧化钠
金合金抛光所用抛光剂是()
A、硼砂
B、氧化铜
C、氧化铁
D、浮石
E、氧化铬
请回答下列与物质提纯有关的问题:
(1)下列两个方案都可以除去铜粉中的少量氧化铜
①用稀盐酸除去氧化铜②用CO还原氧化铜
从环境保护和操作简便等方面考虑,较好的方案是______(选填“①”或“②”);
(2)要除去K2SO4溶液中的少量KOH,不能选用稀盐酸,原因是会生成______(填写具体物质的名称或化学式),而引入新的杂质:
(3)要使NaCl溶液中的少量Na2SO4转化为沉淀而除去,可选用适量的______,
(4)要除去氢气中的少量水蒸气和氯化氢气体,将混合气体先通过足量的浓硫酸再通过足量的氢氧化钠溶液后,氢气中仍含有的杂质是______.
请回答下列与物质提纯有关的问题:
(1)下列两个方案都可以除去铜粉中的少量氧化铜
①用稀盐酸除去氧化铜②用CO还原氧化铜
从环境保护和操作简便等方面考虑,较好的方案是_______(选填“①”或“②”);
(2)要除去K2SO4溶液中的少量KOH,不能选用稀盐酸,原因是会生成_____(填写具体物质的名称或化学式),而引入新的杂质;
(3)要使NaCl溶液中的少量Na2SO4转化为沉淀而除去,可选用适量的________;
(4)要除去氢气中的少量水蒸气和氯化氢气体,将混合气体先通过足量的浓硫酸再通过足量的氢氧化钠溶液后,氢气中仍含有的杂质是_____。
目前应用最广泛的脱硫技术是()
A、石灰石/石灰法洗涤
B、干法喷钙
C、氨法
D、氧化铜法